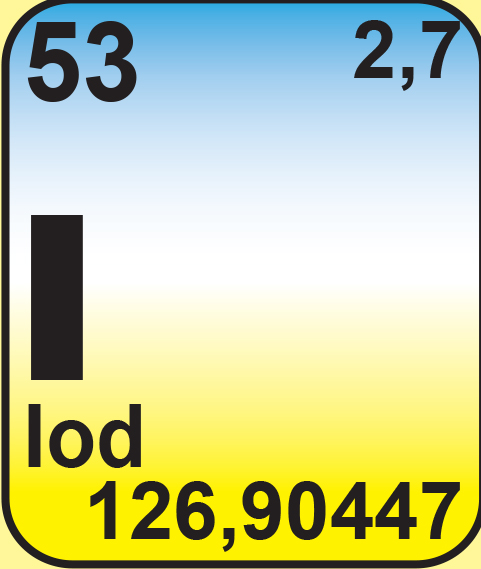
 Iod. (I)
Iod. (I)
Vorkommen
Das seltenste unter den nicht radioaktiven Halogenen, ist in Seen, Mineralwässern, Erdölbohrwässern, im Meer weit verbreitet nur in kleinen Konzentrationen, nicht nur wie bei F, Cl, Br als Halogenid sondern auch als Iodat. Z.B. Ca(IO3)2 Lautarit. Veraschte Tange enthalten Iodide organisch gebunden in der Schilddrüse.
Gewinnung
Darstellung
HIO3 + 3 H2SO3 --> HI + 3 H2SO4
HIO3 + 5 HI --> 3H2O + 3I2
Chemische Eigenschaften
grauschwarze, metallische, kristalline Festsubstanz (halbleitend). schmilzt bei 113,6°C zu einer leitenden Flüssigkeit. Iod ist schon als Feststoff durch Sublimation merklich flüchtig. Charakteristisch ist die Reaktion mit Stärke zu einer blauen Einlagerungsverbindung. Iodwasserstoff, leichter oxidierbar als HBr, wie HBr giftig. Wässrige Lösung Iodwasserstoffsäure. Salze: Iodide. Es gibt eine hypoiodige, iodige, Iod und Periodsäure. Verwendung: Iodhältige Lösungen zur Desinfektion. Iodtinktur (Lösung in Alkohol) für Redoxreaktionen („Iodometrie“), NaI als Zusatz zu Speisesalz.